Aprendemos desde o início que matéria é tudo o que possui massa e ocupa lugar no espaço. Uma boa definição, mas meio sombria. Por que a matéria ocupa lugar no espaço? De que ela é feita? Se pegarmos uma pedra, poderemos quebrá-la indefinidamente? Já na Grécia antiga, os filósofos (como Demócrito e Leucipo) achavam que toda matéria era composta por minúsculas partículas indivisíveis denominadas “átomos” (A = não ; Tomos = divisível). O raciocínio era simples: uma substância sofreria sucessivas divisões, até que não hovesse mais nenhum modo de se partí-la. A esta pequeníssima parte da dita substância é que os gregos deram o nome deátomo. Tão simples assim?
De qualquer forma, alguns séculos mais tarde (no séc. XIX para ser preciso), o cientista inglês John Dalton retornou a este assunto, propondo que o átomo realmente era uma pequeníssima esfera, maciça, indivisível, homogênea e de massa e volume que variavam de acordo com o elemento em questão.
Puxa, que ótimo, não é mesmo? Infelizmente isso não esclareceu muita coisa. O que Dalton quis dizer é que os elementos são diferentes entre si, porque suas minúsculas partículas formadoras são diferentes. Assim, seu volume, massa e demais propriedades físicas estavam intimamente ligadas à natureza destas partículas.
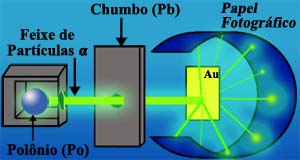
Em 1911, o cientista neozelandês Ernest Rutherford realizou o seguinte experiência: Ele encerrou certa quantidade de uma substância radioativa – o polônio (Po) – num bloco de chumbo (Pb) com um orifício ao centro. O Polônio emite certas partículas de carga elétrica positiva (denominadas “partículas α”). Estas partículas passavam por uma placa de chumbo com um orifício também, atravessavam uma finíssima placa de ouro (Au) e atingiam um papel fotográfico comum, sensibilizando o mesmo. O esquema acima ilustra a experiência de Rutherford.
Rutherford notou que parte das partículas atravessavam a lâmina, enquanto que as demais desvia-vam ou mesmo retrocediam. Com isso, ele concluiu que a lâmina de ouro não era composta por átomos maciços e justapostos, como pensara Dalton. Muito pelo contrário, a lâmina deveria ser formada por núcleos pequenos, densos e positivamente carregados, dispersos em grandes espaços vazios. No esquema a seguir, você pode notar os círculos positivos (núcleos atômicos) e os feixes de partículas a que passam ou se desviam deles.
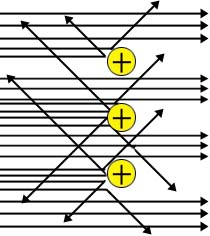
Como ele conseguiu este raciocínio? Muito simples: Sendo as partículas a possuintes de carga elétrica positiva, elas são repelidas por outra partícula de carga elétrica positiva (os opostos se atraem e os semelhantes se repelem), estas partículas têm que ser densas, pois, caso contrário, elas é que seriam deslocadas pelas partículas a e, finalmente, estas partículas estão em imensos espaços vazios, devido ao fato de só uma pequena parte das emissões se desviarem ou retrocederem.
Ora, ora. Agora surge uma dúvida: Se o ouro (Au), apresenta núcleos positivos, então como é que a lâmina é eletricamente neutra? Bom, como você deve estar fazendo agora, Rutherford imaginou que ao redor do núcleo positivo estariam girando partículas muito menores possuidoras de carga elétrica negativa, as quais foram denominadas “elétrons”. Bem, resumindo podemos dizer que o átomo seria como o nosso sistema solar, onde o núcleo positivo (cujas partículas foram chamadas de prótons) seria o sol e os elétrons, os planetas. Só que agora aparece mais uma dúvida: Se o núcleo é composto por várias partículas de carga elétrica positiva, então como é que estas partículas não sofrem repulsão entre si? De fato, se o núcleo fosse constituído apenas de partículas positivas, elas se repeleriam mutuamente, o núcleo deixaria de ser núcleo e o átomo não existiria. No núcleo existe também algumas partículas de carga elétrica nula denominadas “nêutrons”, os quais agem como se fossem verdadeiros “isolantes”, evitando assim a repulsão entre os prótons.
Posteriormente, o cientista Niels Bohr, através de cálculos matemáticos, chegou a algumas conclusões muito importantes:
- Enquanto o elétron estiver na mesma órbita, ele não emite nem absorve energia
- Ao receber uma quantidade bem definida de energia (denominada “quantum” ou, no plural, “quanta” de energia) o elétron salta para uma órbita mais externa
- Quando o elétron volta para a sua órbita de origem, ele devolve a energia recebida sob a forma de luz de cor bem definida, também chamada “fóton”.
Para ver esse artigo completo clique no titulo ou aqui: http://ceticismo.wordpress.com/2006/12/03/constituicao-da-materia/













